I benefici degli omega 3 sono molti, ma ce ne sono alcuni che in poche persone conoscono. In questo articolo vediamo la parte “nascosta” degli omega 3 e dei loro benefici.
Disclaimer: lo scopo di questo articolo è puramente a scopo divulgativo e pertanto ogni responsabilità per eventuali errori, informazioni non aggiornate o imprecisioni presenti viene declinata: tale articolo deve in alcun modo intendersi come sostituto a prestazione professionale del proprio medico biologo nutrizionista: l'uso di queste indicazioni è quindi a carico del lettore, che se ne assume il rischio.
Nella prima parte dell'articolo dell’articolo abbiamo parlato dei benefici degli omega 3 sul metabolismo lipidico, sul cuore e sul sistema cardiovascolare in genere.
Oggi parliamo del rapporto tra gli omega3 negli altri campi della medicina, nello sport e nel bodybuilding, spesso trascurati e conosciuti da poche persone.
L'articolo richiede qualche minuto di attenzione: se non hai tempo, scarica il Pdf e leggi con calma.
Scarica l'Articolo in Pdf
Effetti omega 3
Un grosso RCT a doppio cieco ha dimostrato l’utilità degli omega-3 nel trattamento della malattia di Alzheimer, rallentando il declino della funzione cognitiva in un sottogruppo con avanzamento della malattia meno grave che ha ricevuto una somministrazione di 2,3 gr die [1].
L’effetto sarebbe dato principalmente dal DHA che limiterebbe la produzione e l’accumulo di beta amiloide responsabile della malattia. Gli omega 3 sopprimerebbero anche diverse vie di trasduzione del segnale indotte da beta amiloide [2].
Sempre in ambito neurologico, in soggetti sani, un recente RCT a doppio cieco [3] ha dimostrato come l’uso di 4 gr circa di omega-3 al giorno per 1 mese circa abbia provocato un miglioramento dell’umore, dell’attenzione, del tempo di reazione e del processo decisionale.
È stata inoltre riscontrata l’utilità degli omega 3 anche nell’ADHD (deficit di attenzione /iperattività), che risulta il più comune disturbo neuropsichiatrico dello svilluppo infantile. Vari RCT a doppio cieco, anche se alcune volte con esiti misti, hanno ottenuto un miglioramento dei sintomi della ADHD dopo somministrazione di omega-3 [4-9].
Dolori Articolari
Il dolore articolare e muscolo-tendineo cronico è un problema che affligge molti sportivi e bodybuilders dato lo stress notevole che subiscono le articolazioni, spesso dovute ad esecuzione approssimative e sbagliate.
Molti tipi di dolore contribuiscono al dolore cronico, inclusi il dolore infiammatorio dovuto a danno tessutale, e il dolore neuropatico.
Il dolore cronico è tipicamente caratterizzato da iperalgesia, che è una risposta aumentata a stimoli nocivi termici e meccanici ed allodinia in cui ci sono risposte nocicettive a stimoli normalmente innocui come un leggero toccamento (conosciuto come allodinia meccanica). Il dolore neuropatico è caratterizzato anche da dolore bruciante, parestesia (una sensazione di formicolio e solletico, punture e forature) e disestesia (un anormale, spiacevole senso tattile).
Il dolore è una delle caratteristiche cardinali dell’infiammazione.
E’ ben stabilito che i mediatori infiammatori rilasciati localmente dopo un danno tessutale – inclusi i classici mediatori (per es., bradichinina, prostaglandine, H+, ATP, nerve growth factor), citochine pro-infiammatorie e chemochine così come mediatori emergenti (peptidi batterici N-formilati e micro-RNA) – possono stimolare direttamente e causare sensibilizzazione di nocicettori dolorifici localizzati nelle fibre nervose di neuroni afferenti primari nei tessuti periferici.
L’infiammazione provoca il dolore attraverso mediatori infiammatori e sensibilizzazione periferica ed il danno tessutale insieme all'infezione causano infiammazione attraverso estravasazione plasmatica ed infiltrazione di cellule immuni come macrofagi, cellule T, e neutrofili nel tessuto danneggiato.
Le cellule immuni infiltrate e le cellule residenti che includono mastcellule, macrofagi e cheratinociti rilasciano molti mediatori infiammatori, come bradichinina, prostaglandine, H+, ATP, nerve growth factor (NGF), citochine proinfiammatorie (TNF-α, IL-1β, IL-6), e chemochine proinfiammatorie (CCL2, CXCL1, CXCL5).
I neuroni nocicettivi esprimono i recettori per tutti questi mediatori infiammatori, che agiscono sui propri rispettivi recettori nelle fibre nervose nocicettive periferiche.
Questi recettori includono i GPCR, recettori ionotropici, e recettori a tirosin chinasi, e la loro attivazione risulta nella generazione di un secondo messaggero come Ca2+ e cAMP, che a loro volta attivano molte chinasi, come PKA, PKC, CaMK, PI3K, e le MAPK (ERK, p38, e JNK).
L’attivazione di queste chinasi causa ipersensibilità ed ipereccitabilità dei neuroni nocicettivi (nota come sensibilizzazione periferica), attraverso la modulazione di molecole chiave di trasduzione come i canali ionici transient receptor potential A1 e V1 (TRPA1 e TRPV1) e Piezo (un canale ionico attivato dalla distensione) così come molecole chiave di conduzione come i canali del sodio NaV1.7, NaV1.8 e NaV1.9.
I neuroni nocicettivi esprimono anche i TLR (cioè, TLR3, TLR4, e TLR7), che possono essere attivati da ligandi esogeni (conosciuti come quadri molecolari attivati da patogeni, che includono componenti virali e batteriche) e ligandi endogeni (conosciuti come quadri molecolari attivati dal danno, come gli RNA).
Alcuni miRNA (per es., let-7b) funzionano come dei nuovi mediatori del dolore per attivare i nocicettori attraverso TLR7 che è accoppiato a TRPA1 (l’accoppiamento è ulteriormente aumentato quando TLR7 è attivato da let-7b).
Che c’entrano con questo gli omega-3?
Il loro metabolismo produce intermedi diidrossilati e triidrossilati che prendono il nome di resolvine e protectine.
Avere come bersaglio mediatori lipidici che promuovono la risoluzione dell’infiammazione potrebbe essere un’altra via per combattere la neuroinfiammazione.
E’ degno di nota che questi mediatori lipidici, come le resolvine e le protectine, non agiscono solo sulle cellule immuni e sulle cellule gliali ma agiscono anche su neuroni ed hanno azioni neuroprotettive
Nonostante gli acidi grassi non saturi omega-3 acido deicosaenoico (DHA) e acido eicosapentanoico (EPA), che sono metabolizzati per produrre resolvine e protectine, diano molti benefici tra cui il sollievo dal dolore, quando usati sperimentalmente, l’efficacia analgesica e la potenza delle resolvine e delle protectine, sono molto più alte.
Le resolvine, come la resolvina D1 (RvD1), resolvina D2 (RvD2), e resolvina E1 (RvE1), e la protectina D1 rappresentano una classe di mediatori lipidici pro-risoluzione (PRLM).
Le resolvine sono state isolate in origine da essudati infiammatori che erano coinvolti nella risoluzione dell’infiammazione in roditori e nell’uomo ed hanno potenti azioni anti-infiammatorie e pro-risoluzione in molti modelli di roditori di infiammazione, come la colite, polmonite e danno acuto al polmone, ed ischemia renale.
La protectina D1 è chiamata anche neuroprotectina D1, in quanto protegge contro il danno sperimentale del cervello, lo stress ossidativo nelle cellule pigmentate epiteliali della retina, e contro l’accumulo di peptide beta-amiloide in cellule di cervello umano in coltura.
La stechiometria completa della protectina D1 e la struttura di 10,17-deicosatriene sono stati confermati tramite sintesi organica totale. E’ degno di nota che gli enzimi responsabili della sintesi delle resolvine e delle protectine come la lipossigenasi-5 e la lipossigenasi-12 (LOX-5/12) e la ciclossigenasi-2 possono essere indotti nelle fasi acute o di risoluzione dell’infiammazione. Quindi, se l’olio di pesce (che comprende DHA ed EPA) consumato (digerito) possa essere convertito a resolvine e protectine dipende dall’attività di questi enzimi.
Le azioni biologiche di questi mediatori lipidici sono mediate da GPCR. Per esempio, ChemR23 è stato identificato come recettore di RvE1, mentre GPR32 e ALX sono stati identificati come recettori per RvD1. Tuttavia, GPCR specifici per RvD2 e protectina D1 devono ancora essere trovati. Nei prossimi paragrafi, discuteremo le azioni delle resolvine e della protectina D1 nei roditori e le loro potenzialità traslazionali.
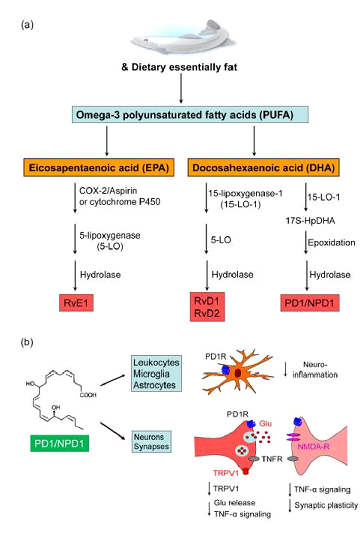 Vie biosintetiche delle resolvine e della protectina PRLM e meccanismi d’azione della protectina D1
Vie biosintetiche delle resolvine e della protectina PRLM e meccanismi d’azione della protectina D1
(a) Gli acidi grassi polinsaturi Omega-3 (DHA ed EPA) sono derivati da grassi essenziali della dieta arricchiti in olio di pesce. Le resolvine (RvD1, RvD2) e la protectina D1 (PD1, nota anche come neuroprotectina D1) sono derivate da DHA, mentre RvE1 è derivata da EPA.
Enzimi sintetici distinti, incluso COX-2, citocromo P450, e 5- e 15-lipossigenasi (5-LOX e 12-LOX) sono responsabili della biosintesi delle PRLM. (b) Struttura e meccanismo d’azione di PD1. Nota che PD1 agisce sulle cellule immuni e gliali per controllare la neuro infiammazione così come sui neuroni e sulle sinapsi per normalizzare la plasticità sinaptica e neuronale.
L’iniziezione periferica (intraplantare) di RvD1 e RevE1 previene efficacemente il dolore infiammatorio e riduce anche l’edema della zampa indotta dall’infiammazione e l’espressione di citochine proinfiammatorie e chemochine (TNF-α, IL-1β, IL-6, CCL2) nei topi.
Inoltre, la somministrazione spinale molto rapida (< 15 min) di RvE1 inibisce il dolore infiammatorio persistente, a dosi efficaci che erano circa 100 volte più basse di quelle della morfina. RvE1 e protectina D1 sono inibitori potenti del segnale del TNF-α:
l’iperalgesia spinale evocata dal TNF-α può essere bloccata dalla somministrazione intratecale di RvE1 e protectina D1, suggerendo ulteriormente l’importanza delle PRLM nella modulazione delle funzioni del SNC [10, 11, 12]
Omega 3 e Insulino-Resistenza
Un articolo pubblicato nel 3 settembre 2010 sulla rivista Cell riporta la scoperta di alcuni ricercatori presso l'Università della California, San Diego – School of Medicine, del meccanismo utilizzato dagli acidi grassi omega-3 nel ridurre la resistenza all'insulina.
Queste ricerche hanno rivelato che cinque membri di una famiglia di molecole note come recettori G, accoppiati alla proteina G appunto, rispondono al legame degli omega 3.
Utilizzando colture di cellule, Jerrold Olefsky e colleghi hanno scoperto che l'esposizione agli acidi grassi omega-3 attiva uno di questi recettori cellulari.
Il recettore, noto come GPR120, si trova sui macrofagi in cellule adipose mature e, se attivato, impedisce i macrofagi di causare infiammazione.
I ricercatori hanno confrontato gli effetti di diete integrate con gli acidi grassi omega-3 EPA e DHA nei topi allevati per la mancanza del recettore GPR120 e topi normali.
Prima di ricevere EPA e DHA, entrambi i gruppi di animali hanno ricevuto diete ad alto contenuto di grassi per 15 settimane per indurre l'obesità e insulino-resistenza. Mentre i topi normali con il recettore migliorarono la sensibilità all'insulina e l'infiammazione risultò ridotta dopo 5 settimane di supplementazione con omega-3, topi privi del recettore non riuscirono a trarre vantaggio dagli omega-3.
Le capacità insulino-sensibilizzanti di EPA e DHA erano uguali o maggiori di quello riscontrato per il farmaco rosiglitazone, usato in un gruppo di controllo separato di topi normali per il recettore ma obesi.
Perché gli omega 3 si legano a un recettore dell infiammazione sui macrofagi? Che rapporto hanno grasso, obesità e infiammazione?
L'obesità è associata con la sindrome metabolica, un fattore di rischio per lo sviluppo di diabete di tipo 2 e di malattie cardiovascolari.
Una infiammazione cronica di basso grado che si verifica nel tessuto adiposo dei soggetti obesi è causalmente legata alla patogenesi della insulino-resistenza e della sindrome metabolica.
Sebbene l’esatta causa scatenante di questo processo infiammatorio è sconosciuta, l’ipossia del tessuto adiposo, lo stress del reticolo endoplasmatico, e l'attivazione, mediata da acidi grassi saturi, di processi di immunità innata, sono stati identificati come processi che causano questa patologia.
Inoltre, macrofagi e linfociti T hanno un ruolo importante in questa orchestrata reazione immune.
In questa situazione, omega 3 come EPA e DHA possono migliorare l’insulino-resistenza e addirittura ritardare l’insorgenza e la progressione della sindrome metabolica [13].
Il tessuto adiposo bianco è il sito principale per lo stoccaggio di energia in eccesso nel corpo.
È composto di adipociti, una matrice extracellulare (ECM), tessuti vascolari e neurali, e altri tipi di cellule [14]. Questi altri tipi di cellule comprendono preadipociti, fibroblasti, cellule staminali, e cellule immunitarie quali macrofagi e linfociti T.
Il tessuto adiposo secerne peptidi bioattivi noti collettivamente come adipochine [15, 16]. Gli esempi includono ormoni coinvolti nella produzione di energia e omeostasi del glucosio, come la leptina, adiponectina, resistina, apelina, e visfatina; chemochine come la proteina chemiotattica dei monociti ( MCP -1) e IL-8 (interleukina 8); altre citochine proinfiammatorie quali IL-6, IL-1, angiotensina-II, e TNF-α (tumor necrosis factor); e citochine infiammatorie come IL-10.
Così, il tessuto adiposo è un organo endocrino dinamico con importanti ruoli nel bilancio energetico, l'omeostasi del glucosio, regolazione della pressione sanguigna e la funzione immunitaria [17].
Un accumulo eccessivo di trigliceridi dentro gli adipociti, presumibilmente legato al sovraccarico del tessuto adiposo come risultato di un bilancio energetico positivo, porta all’ipertrofia degli adipociti e ad una disregolazione del pattern di secrezione delle adipochine.
Questo è stato attribuito principalmente a uno squilibrio tra le secrezioni di adipochine proinfiammatorie rispetto a quelle antinfiammatorie. Così, l'obesità è associata ad una infiammazione cronica di basso grado nel tessuto adiposo [18, 19].
Sebbene gli adipociti siano una fonte di citochine proinfiammatorie nell'obesità [20], cellule come i preadipociti [21], i macrofagi e cellule staminali adipose possono produrre livelli ancora più elevati di queste citochine [22]. 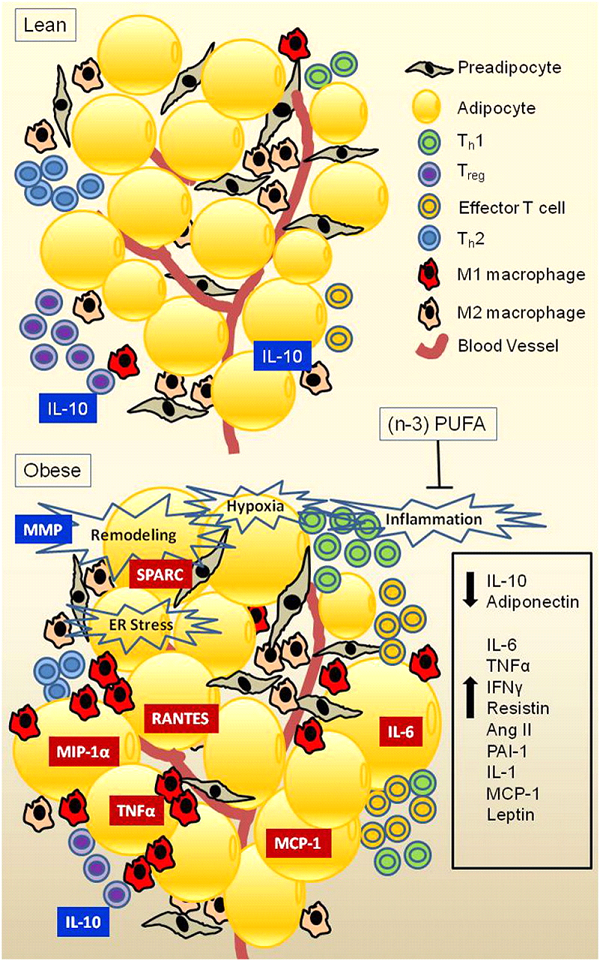
Sebbene l’esatta causa scatenante che provoca l'insorgenza di infiammazione del tessuto adiposo è finora sconosciuta, diversi possibili meccanismi sono stati proposti e discussi.
In uno stato di equilibrio energetico positivo, il tessuto adiposo si espande per stoccare un eccesso di trigliceridi (TG).
Il rimodellamento del tessuto adiposo mediante degradazione della matrice extracellulare (ECM) e l’adipogenesi sono 2 processi chiave in questa espansione. Metalloproteinasi della matrice e inibitori tissutali delle metalloproteinasi svolgono un ruolo importante nella degradazione ECM e nel rimodellamento del tessuto adiposo [23 , 24].
La diffettosa espansione del tessuto adiposo a causa della disregolazione di uno qualsiasi dei fattori di cui sopra potrebbe portare a lesioni degli adipociti, alla morte, e all'infiammazione [25].
Studi sui roditori mostrano che aumentando la massa adiposa senza un aumento di analoga entità del supporto vascolare si produrrebbe ipossia tissutale [26].
Analogamente, la ridotta pressione parziale di ossigeno nel tessuto adiposo sottocutaneo si correla negativamente con adiposità nell'uomo [27].
L’ipossia potrebbe quindi essere un innesco per l'infiammazione del tessuto adiposo. Entrambi gli studi umani e animali supportano il ruolo del tessuto adiposo stress del reticolo endoplasmatico (ER) come un altro elicitor chiave per la successiva infiammazione obesità [28-31].
Anche se vi è evidenza che l'espansione del tessuto adiposo di per sé è un iniziatore importante dei processi infiammatori durante lo sviluppo dell'obesità, altre linee di evidenza suggeriscono che il tipo di grasso alimentare è anche un fattore importante nell'innescare questo processo.
Studi hanno mostrato effetti cronici di acidi grassi nello scatenare l'infiammazione nel tessuto adiposo [32-35].
Al contrario, ci sono studi che dimostrano che l'infiammazione del tessuto adiposo può essere ridotto senza modificare massa adiposa [40, 41]. Questo è anche coerente con il fatto che l'EPA inverte disordini metabolici ad alto contenuto di grassi che induce infiammazione nel tessuto adiposo [42].
EPA e DHA riducono l'adiposità nell'uomo [89] soprattutto se combinato con limitazione di calorie. Questi acidi grassi servono anche a prevenire lo sviluppo di adiposità indotta da una dieta ad alto contenuto di grassi e l’ipertrofia degli adipociti [42, 90].
EPA e DHA
Ci sono 2 possibili meccanismi per gli effetti antiobesità di EPA e DHA.
In primo luogo, questi acidi grassi sono noti per aumentare l'ossidazione degli acidi grassi nel fegato, nel tessuto adiposo [91], e del piccolo intestino [92] nei roditori in vivo. L'olio di pesce aumenta anche l'ossidazione degli acidi grassi nell'uomo con una riduzione del quoziente respiratorio [89].
In secondo luogo, essi sono noti per inibire la lipogenesi epatica.
Entrambi questi processi spostano l'equilibrio del metabolismo degli acidi grassi verso l'ossidazione, piuttosto che di stoccaggio. EPA e DHA attivano AMPK nel tessuto adiposo e negli adipociti in coltura, e questo potrebbe essere un meccanismo per il loro effetto sulla ossidazione degli acidi grassi [95, 96].
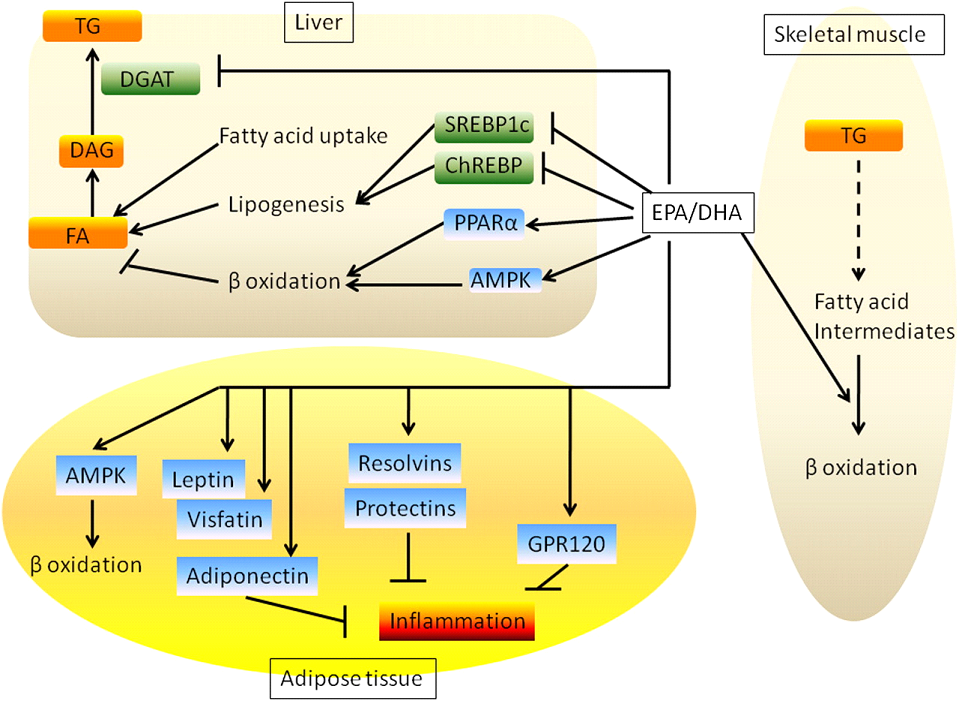
Sebbene sia possibile che i miglioramenti della resistenza sistemica insulina per EPA e DHA sono secondarie a riduzione della massa adiposa, questo potrebbe anche essere dovuto alle azioni dirette di questi acidi grassi nel migliorare la funzione del tessuto adiposo.
Infatti, alcuni studi hanno dimostrato agli EPA e DHA migliorano la sensibilità all'insulina anche in presenza di un aumento della massa adiposa [97]. EPA e DHA modulano la secrezione di adipochine da tessuto adiposo e aumentano i livelli plasmatici di adiponectina negli esseri umani obesi [98, 99] che potrebbe essere un potenziale meccanismo attraverso il quale EPA e DHA migliorano la sensibilità all'insulina.
Questo effetto di EPA e DHA sulla adiponectina è PPAR-dipendente, perché l’adiponectina non è elevata in risposta a olio di pesce in topi mancanti di PPAR [101]. Inoltre EPA e DHA inducono la secrezione di leptina e visfatina e riducono l'espressione di diverse citochine proinfiammatorie dal tessuto adiposo, compresi TNF, IL-6, MCP-1 e PAI-1 [42, 102-104].
L'evidenza attuale suggerisce che queste azioni antinfiammatori di EPA e DHA svolgono un ruolo importante nei loro effetti insulino-sensibilizzanti.
Recenti evidenze mostrano il ruolo di EPA e DHA per risolvere l'infiammazione, attraverso meccanismi che coinvolgono resolvina EPA-derivato E1 e protectina DHA-derivato D1 [108].
Eicosanoidi derivati dall’acido arachidonico quali PGE-2 e trombossano A2 sono proinfiammatorie, mentre quelli EPA-derivati quali PGE-3 sono molto meno infiammatori. Poiché superiori quantità assunte di EPA e DHA producono una maggior incorporazione di questi nei fosfolipidi di membrana a spese dell’acido arachidonico, è possibile che la supplementazione di EPA e DHA riduca la produzione di eicosanoidi derivati dall’acido arachidonico.
Questo può anche contribuire agli effetti antinfiammatori di questi acidi grassi.
L'effetto di EPA e DHA, soprattutto EPA, sulla riduzione dei TG plasmatici è ben consolidata.
Questo effetto è almeno in parte a causa della loro capacità di inibire l’enzima epatico diacilglicerolo aciltransferasi [113], che catalizza la reazione finale della sintesi dei TG. Oltre a questo effetto di riduzione dei TG, EPA e DHA impediscono anche lo sviluppo di steatosi epatica associata ad alimentazione con alti grassi saturi nei roditori [114].
Nell’obesità vi è un aumento netto di disponibilità di acidi grassi, promuovendosi così la deposizione di lipidi nel fegato. Inoltre, fattori di trascrizione genica lipogenici sono espressi a un livello superiore nell’obesità [115].
Questo porta ad un aumento dell'espressione di geni lipogenici nel fegato, come l’enzima acido grasso sintasi e stearoil-CoA desaturasi 1 [116]. Inoltre, l'obesità è anche associata con soppressione di PPARa [115] che porta a una ridotta ossidazione degli acidi grassi ridotta [116].
Tutti questi processi sono legati allo sviluppo della steatosi epatica. Eccessivo accumulo di lipidi nel fegato porta alla insulino-resistenza epatica e a un ottundimento della soppressione insulino-mediata della produzione epatica di glucosio.
EPA riduce la lipogenesi e aumenta l'ossidazione degli acidi grassi [117], evitando l'accumulo di lipidi nel fegato e portando a miglioramenti nella resistenza all'insulina epatica. Inoltre, l'EPA riduce la lipogenesi attraverso l'inibizione di fattori di trascrizione lipogenici [119].
EPA stimola l'ossidazione degli acidi grassi attraverso l'attivazione di PPARa [116, 120-122] e AMPK [123]. PPARa è necessario per gli effetti benefici di EPA su epatica sensibilità all'insulina, come evidenziato da una mancanza di effetto EPA nel ripristino epatica sensibilità all'insulina nei topi PPARa nullo alimentati con una dieta ricca di grassi [124].
Dosaggio
Tutti farete questa domanda: DIPENDE. Dipende dalla vostra dieta, abitudini alimentari. Gli omega 3 si trovano in svariati alimenti. Quindi bisogna regolarsi in base alla quota assunta con la dieta e alla possibilità di aumentare o non, al rapporto con gli omega 6 o alla necessità di migliorare la sensibilità all'insulina.
Tutte cose individuali, come lo stato di salute ed eventuali patologie sottostanti, che non è facile riassumere in un numero “prendi x grammi”.
![]() Anche tu vuoi ottenere il massimo da dieta, allenamento e integratori? Allora scopri The Body Solution: la Soluzione definitiva per Nutrire, Allenare e Integrare il tuo corpo.
Anche tu vuoi ottenere il massimo da dieta, allenamento e integratori? Allora scopri The Body Solution: la Soluzione definitiva per Nutrire, Allenare e Integrare il tuo corpo.
Articolo a cura del dott. Francesco Celso













 P.IVA: IT 02313270502
P.IVA: IT 02313270502